Kristal
Kristal adalah suatu padatan yang atom, molekul, atau ion penyusunnya terkemas secara teratur dan polanya berulang melebar secara tiga dimensi.
Secara umum, zat cair membentuk kristal ketika mengalami proses pemadatan. Pada kondisi ideal, hasilnya bisa berupa kristal tunggal, yang semua atom-atom dalam padatannya "terpasang" pada kisi atau struktur kristal yang sama, tapi, secara umum, kebanyakan kristal terbentuk secara simultan sehingga menghasilkan padatan polikristalin. Misalnya, kebanyakan logam yang kita temui sehari-hari merupakan polikristal.
Struktur kristal mana yang akan terbentuk dari suatu cairan tergantung pada kimia cairannya sendiri, kondisi ketika terjadi pemadatan, dan tekanan ambien. Proses terbentuknya struktur kristalin dikenal sebagai kristalisasi.
Kristal quartz
Meski proses pendinginan sering menghasilkan bahan kristalin, dalam keadaan tertentu cairannya bisa membeku dalam bentuk non-kristalin. Dalam banyak kasus, ini terjadi karena pendinginan yang terlalu cepat sehingga atom-atomnya tidak dapat mencapai lokasi kisinya. Suatu bahan non-kristalin biasa disebut bahan amorf atau seperti gelas. Terkadang bahan seperti ini juga disebut sebagai padatan amorf, meskipun ada perbedaan jelas antara padatan dan gelas. Proses pembentukan gelas tidak melepaskan kalor lebur jenis (Bahasa Inggris: latent heat of fusion). Karena alasan ini banyak ilmuwan yang menganggap bahan gelas sebagai cairan, bukan padatan. Topik ini kontroversial, silakan lihat gelas untuk pembahasan lebih lanjut.

Struktur kristal terjadi pada semua kelas material, dengan semua jenis ikatan kimia. Hampir semua ikatan logam ada pada keadaan polikristalin; logam amorf atau kristal tunggal harus diproduksi secara sintetis, dengan kesulitan besar. Kristal ikatan ion dapat terbentuk saat pemadatan garam, baik dari lelehan cairan maupun kondensasi larutan. Kristal ikatan kovalen juga sangat umum. Contohnya adalah intan, silika dan grafit. Material polimer umumnya akan membentuk bagian-bagian kristalin, namun panjang molekul-molekulnya biasanya mencegah pengkristalan menyeluruh. Gaya Van der Waals lemah juga dapat berperan dalam struktur kristal. Contohnya, jenis ikatan inilah yang menyatukan lapisan-lapisan berpola heksagonal pada grafit.
Kebanyakan material kristalin memiliki berbagai jenis cacat kristalografis. Jenis dan struktur cacat-cacat tersebut dapat berefek besar pada sifat-sifat material tersebut.

Meskipun istilah "kristal" memiliki makna yang sudah ditentukan dalam ilmu material dan fisika zat padat, dalam kehidupan sehari-hari "kristal" merujuk pada benda padat yang menunjukkan bentuk geometri tertentu, dan kerap kali sedap di mata. Berbagai bentuk kristal tersebut dapat ditemukan di alam. Bentuk-bentuk kristal ini bergantung pada jenis ikatan molekuler antara atom-atom untuk menentukan strukturnya, dan juga keadaan terciptanya kristal tersebut. Bunga salju, intan, dan garam dapur adalah contoh-contoh kristal.
Beberapa material kristalin mungkin menunjukkan sifat-sifat elektrik khas, seperti efek feroelektrik atau efek piezoelektrik.
Kelakuan cahaya dalam kristal dijelaskan dalam optika kristal. Dalam struktur dielektrik periodik serangkaian sifat-sifat optis unik dapat ditemukan seperti yang dijelaskan dalam kristal fotonik.
Kristalografi adalah studi ilmiah kristal dan pembentukannya.

Berbagai kristal
Sampai di sini, kristal telah diklasifikasikan berdasarkan cara penyusunan partikelnya. Kristal juga dapat diklasifikasikan dengan jenis partikel yang menyusunnya atau dengan interaksi yang menggabungkan partikelnya (Tabel 8.2).
Tabel 8.2 Berbagai jenis kristal
| logam | ionik | molekular | kovalen | ||||
| Li | 38 | LiF | 246,7 | Ar | 1,56 | C(intan) | 170 |
| Ca | 42 | NaCl | 186,2 | Xe | 3,02 | Si | 105 |
| Al | 77 | AgCl | 216 | Cl | 4,88 | SiO2 | 433 |
| Fe | 99 | Zn | 964 | CO2 | 6,03 | ||
| W | 200 | CH4 | 1,96 | ||||
Nilai yang tercantum di atas adalah energi yang diperlukan untuk memecah kristal menjadi partikel penyusunnya (atom, ion, atau molekul (dalam kkal mol-1))
a. Kristal logam
Kisi kristal logam terdiri atas atom logam yang terikat dengan ikatan logam. Elektron valensi dalam atom logam mudah dikeluarkan (karena energi ionisasinya yang kecil) menghasilkan kation. Bila dua atom logam saling mendekat, orbital atom terluarnya akan tumpang tindih membentuk orbital molekul. Bila atom ketiga mendekati kedua atom tersebut, interaksi antar orbitalnya terjadi dan orbital molekul baru terbentuk.
Sifat-sifat logam yang bemanfaat seperti kedapat-tempa-annya, hantaran listrik dan panas serta kilap logam dapat dihubungkan dengan sifat ikatan logam. Misalnya, logam dapat mempertahankan strukturnya bahkan bila ada deformasi. Hal ini karena ada interaksi yang kuat di berbagai arah antara atom (ion) dan elektron bebas di sekitarnya (Gambar 8.8).

Gambar 8.8 Deformasi sruktur logam.
Logam akan terdeformasi bila gaya yang kuat diberikan, tetapi logam tidak akan putus. Sifat ini karena interaksi yang kuat antara ion logam dan elektron bebas.
Tingginya hantaran panas logam dapat juga dijelaskan dengan elektron bebas ini. Bila salah satu ujung logam dipanaskan, energi kinetik elektron sekitar ujung itu akan meningkat. Peningkatan
energi kinetik dengan cepat ditransfer ke elektron bebas. Hantaran listrik dijelaskan dengan cara yang sama. Bila beda tegangan diberikan pada kedua ujung logam, elektron akan mengalir ke arah muatan yang positif.
Kilap logam diakibatkan oleh sejumlah besar orbital molekul kristal logam. Karena sedemikian banyak orbital molekul, celah energi antara tingkat-tingkat energi itu sangat kecil. Bila permukaan logam disinari, elektron akan mengabsorbsi energi sinar tersebut dan tereksitasi. Akibatnya, rentang panjang gelombang cahaya yang diserap sangat lebar. Bila elektron yang tereksitasi melepaskan energi yang diterimanya dan kembali ke keadaan dasar, cahaya dengan rentang panjang gelombang yang lebar akan dipancarkan, yang akan kita amati sebagai kilap logam.
b. Kristal ionik
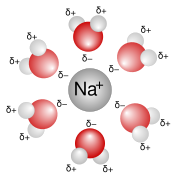
Kristal ionik semacam natrium khlorida (NaCl) dibentuk oleh gaya tarik antara ion bermuatan positif dan negatif. Kristal ionik biasanya memiliki titik leleh tinggo dan hantaran listrik yang rendah. Namun, dalam larutan atau dalam lelehannya, kristal ionik terdisosiasi menjadi ion-ion yang memiliki hantaran listrik.
Biasanya diasumsikan bahwa terbentuk ikatan antara kation dan anion. Dalam kristal ion natrium khlorida, ion natrium dan khlorida diikat oleh ikatan ion. Berlawanan dengan ikatan kovalen, ikatan ion tidak memiliki arah khusus, dan akibatnya, ion natrium akan berinteraksi dengan semua ion khlorida dalam kristal, walaupun intensitas interaksi beragam. Demikian juga, ion khlorida akan berinteraksi dengan semua ion natrium dalam kristal.
Susunan ion dalam kristal ion yang paling stabil adalah susunan dengan jumlah kontak antara partikel bermuatan berlawanan terbesar, atau dengan kata lain, bilangan koordinasinya terbesar. Namun, ukuran kation berbeda dengan ukuran anion, dan akibatnya, ada kecenderungan anion yang lebih besar akan tersusun terjejal, dan kation yang lebih kecil akan berada di celah antar anion.
Dalam kasus natrium khlorida, anion khlorida (jari-jari 0,181 nm) akan membentuk susunan kisi berpusat muka dengan jarak antar atom yang agak panjang sehingga kation natrium yang lebih kecil (0,098 nm) dapat dengan mudah diakomodasi dalam ruangannya (Gambar 8.9(a)). Setiap ion natrium dikelilingi oleh enam ion khlorida (bilangan koordinasi = 6). Demikian juga, setiap ion khlorida dikelilingi oleh enam ion natrium (bilangan koordinasi = 6) (Gambar 8.9(b)). Jadi, dicapai koordinasi 6:6.
Gambar 8.9 Struktur kristal natrium khlorida
Masing-masing ion dikelilingi oleh enam ion yang muatannya berlawanan.
Struktur ini bukan struktur terjejal.
Dalam cesium khlorida, ion cesium yang lebih besar (0,168nm) dari ion natrium dikelilingi oleh 8 ion khlorida membentuk koordinasi 8:8. Ion cesium maupun khlorida seolah secara independen membentuk kisi kubus sederhana, dan satu ion cesium terletak di pusat kubus yang dibentuk oleh 8 ion khlorida (Gambar 8.10)

Gambar 8.10 Struktur kristal cesium khlorida.
Setiap ion dikelilingi oleh delapan ion dengan muatan yang berlawanan.
Struktur ini juga bukan struktur terjejal.
Jelas bahwa struktur kristal garam bergantung pada rasio ukuran kation dan anion. Bila rasio (jarijari kation)/(jari-jari anion) (rC/rA) lebih kecil dari nilai rasio di natrium khlorida, bilangan koordinasinya akan lebih kecil dari enam. Dalam zink sulfida, ion zink dikelilingi hanya oleh empat ion sulfida. Masalah ini dirangkumkan di tabel 8.3.
Tabel 8.3 Rasio jari-jari kation rC dan anion rA dan bilangan koordinasi.
| Rasio jari-jari rC/rA | Bilangan koordinasi | contoh |
| 0,225-0,414 | 4 | ZnS |
| 0,414-0,732 | 6 | Sebagian besar halida logam alkali |
| >0,732 | 8 | CsCl, CsBr, CsI |
Latihan 8.4 Penyusunan dalam kristal ion
Dengan menggunakan jari-jari ion (nm) di bawah ini, ramalkan struktur litium fluorida LiF dan rubidium bromida RbBr. Li+ = 0,074, Rb+ = 0,149, F- = 0,131, Br- = 0<196>
Jawab
Untuk LiF, rC/rA = 0,074/0,131 = 0,565. Nilai ini berkaitan dengan nilai rasio untuk kristal berkoordinasi enam, sehingga LiF akan bertipe NaCl. Untuk RbBr, rC/rA = 0,149/0,196 = 0,760, yang termasuk daerah berkoordinasi 8, sehingga RbBr diharapkan bertipe CsCl.
c. Kristal molekular
Kristal dengan molekul terikat oleh gaya antarmolekul semacam gaya van der Waals disebut dengan kristal molekul. Kristal yang didiskusikan selama ini tersusun atas suatu jenis ikatan kimia antara atom atau ion. Namun, kristal dapat terbentuk, tanpa bantuan ikatan, tetapi dengan interaksi lemah antar molekulnya. Bahkan gas mulia mengkristal pada temperatur sangat rendah. Argon mengkristal dengan gaya van der Waaks, dan titik lelehnya -189,2°C. Padatan argon berstruktur kubus terjejal.
Molekul diatomik semacam iodin tidak dapat dianggap berbentuk bola. Walaupun tersusun teratur di kristal, arah molekulnya bergantian (Gambar 8.11). Namun, karena strukturnya yang sederhana, permukaan kristalnya teratur. Ini alasannya mengapa kristal iodin memiliki kilap.

Gambar 8.11 Struktur kristal iodin.
Strukturnya berupa kisi ortorombik berpusat muka.
Molekul di pusat setiap muka ditandai dengan warna lebih gelap.
Pola penyusunan kristal senyawa organik dengan struktur yang lebih rumit telah diselidiki dengan analisis kristalografi sinar-X. Bentuk setiap molekulnya dalam banyak kasus mirip atau secara esensi identik dengan bentuknya dalam fasa gas atau dalam larutan.
d. Kristal kovalen
Banyak kristal memiliki struktur mirip molekul-raksasa atau mirip polimer. Dalam kristal seperti ini semua atom penyusunnya (tidak harus satu jenis) secara berulang saling terikat dengan ikatan kovelen sedemikian sehingga gugusan yang dihasilkan nampak dengan mata telanjang. Intan adalah contoh khas jenis kristal seperti ini, dan kekerasannya berasal dari jaringan kuat yang terbentuk oleh ikatan kovalen orbital atom karbon hibrida sp3 (Gambar 8.12). Intan stabil sampai 3500°C, dan pada temperatur ini atau di atasnya intan akan menyublim.
Kristal semacam silikon karbida (SiC)n atau boron nitrida (BN)n memiliki struktur yang mirip dengan intan. Contoh yang sangat terkenal juga adalah silikon dioksida (kuarsa; SiO2) (Gambar 8.13). Silikon adalah tetravalen, seperti karbon, dan mengikat empat atom oksigen membentuk tetrahedron. Setiap atom oksigen terikat pada atom silikon lain. Titik leleh kuarsa adalah 1700 °C.

Gambar 8.12 Struktur kristal intan
Sudut ∠C-C-C adalah sudut tetrahedral, dan setiap
atom karbon dikelilingi oleh empat atom karbon lain.

Gambar 8.13 Struktur kristal silikon dioksida
Bila atom oksigen diabaikan, atom silikon akan membentuk struktur mirip intan.
Atom oksigen berada di antara atom-atom silikon.
| partikel | Jenis ikatan | Sifat | Contoh |
| Jaringan atom | Ikatan kovalen berarah | keras Titik leleh tinggi Insulator | intan |
| logam | Ikatan kovalen tak berarah | Kekeresan bervariasi Titik leleh bervariasi konduktor | perak besi |
| Gas mulia | Gaya antarmolekul | Titik leleh sangat rendah | argon |
| Molekul (polar) | Interaksi dipol-dipol | lunak Titik leleh rendah Insulator | es es kering |
| ion | Ikatan ionik | Keras Titik leleh tinggi insulator | natrium khlorida |
e. Kristal cair
Kristal memiliki titik leleh yang tetap, dengan kata laun, kristal akan mempertahankan temperatur dari awal hingga akhir proses pelelehan. Sebaliknya, titik leleh zat amorf berada di nilai temperatur yang lebar, dan temperatur selama proses pelelehan akan bervariasi.
Material seperti ini disebut dengan kristal cair. Molekul yang dapat menjadi kristal cair memiliki fitur struktur umum, yakni molekul-molekul ini memiliki satuan struktural planar semacam cincin benzen. Di Gambar 8.14, ditunjukkan beberapa contoh ristal cair.

Gambar 8.14 Beberapa contoh kristal cair
Dalam kristal-kristal cair ini, dua cincin benzen membentuk rangka planar.
Terdapat tiga jenis kristal cair: smektik, nematik, dan kholesterik. Hubungan struktural antara kristal padat-smektik, nematik dan kholesterik secara skematik ditunjukkan di Gambar 8.15. Kristal cair digunakan secara luas untuk tujuan praktis semacam layar TV atau jam tangan.

Gambar 8.15 Keteraturan dalam kristal cair. Keteraturan adalm kristal adalah tiga dimensi. Dalam kristal cair smektik dapat dikatakan keteraturannya di dua dimensi, dan di nematik satu dimensi. T adalah temperatur transisi.