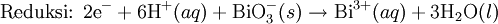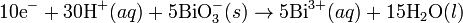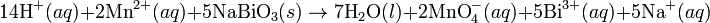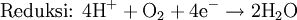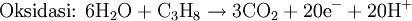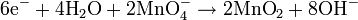Lahirnya konsep sintesis
Kimia memiliki banyak aspek, tetapi ada tiga daerah umum: studi struktur material, studi reaksi material, dan sintesis material. Dulunya dianggap bahwa sintesis lebih dan tidak terlalu teoritis empiris bila dibandingkan dengan studi struktur dan reaksi. Namun, dengan berkembangnya struktur dan reaksi, sintesis juga perlahan menjadi lebih berlandaskan teori dan tersistematisasi. Di bab ini kita akan secara sekilas melihat perkembangan terbaru sintesis modern. Bab ini diharapkan dapat memberikan pengenalan tentang peran penting sintesis dalam kimia modern.

Salah satu tujuan utama kimia adalah menciptakan material penting, atau sintesis material. Dari zaman alkemi, tujuan ini adalah tujuan terpenting yang akan dicapai. Tidak mudah untuk mencapai tujuan ini. Alkemi menyumbangkan karyanya pada lahirnya kimia modern dengan berbagi teknik eksperimen dan alat yang dikembangkannya. Teknik semacam refluks dan distilasi adalah prestasi dari kerja alkemi. Namun bagi alkemi prestasi ini bukan yang mereka cari. Mreka tidak pernah mencapai tujuan utama yang mereka canangkan mensintesis emas, walaupun beberapa mereka melaporkan kesuksesan itu.
Alasan kegagalannya jelas. Kerja mereka berdasarkan atas hipotesis yang salah: teori empat unsur Aristoteles (Bab 1). Target mereka, emas, adalah unsur, tetapi mereka menganggap sejenis senyawa dan menganggap senyawa yang mereka cari dapat diperoleh dengan mencampurkan empat unsur dalam proporsi yang tepat.
Konsep sintesis modern lahir setelah teori atom lahir dan struktur molekul dielusidasi berdasarkan teori atom. Situasi semacam ini akhirnya dicapai di pertengahan abad 19. Teori valensi Kekulé dan Couper diusulkan sekitar tahun 1858. Tidak semua kimiawan pada waktu itu siap menggunakan teori valensi Kekulé , yang dicirikan dengan penggunaan ikatan antar atom. Konsep valensi masih kabur, dan beberapa kimiawan menganggap valensi tidak lebih dari proporsi berbagai jenis atom dalam molekul.
Kimiawan Rusia Aleksandr Mikhailovich Butlerov (1828-1886) dengan semangat mendukung teori Kekulé-Couper dan mendeklarasikan bahwa satu dan hanya satu rumus kimia yang berkaitan dengan satu senyawa dan atom-atom dalam molekul diikat satu sama lain sesuai dengan teori ikatan valensi, serta menolak asumsi umum bahwa atom tersusun secara acak dalam molekul.
Menurutnya, valensi bukan hanya ukuran proporsi atom dalam molekul, valensi juga mendefinisikan pola ikatan antar atom dalam molekul. Ialah yang pertama menggunakan istilah struktur kimia di tahun 1861. 
Menurut teorinya, akan ada isomer bila terdapat dua atau lebih cara atom-atom berikatan untuk satu rumus rasional. Di sekitar waktu itu, kimiawab Jerman, Adolph Wilhelm Hermann Kolbe (1818-1884) berhasl mensintesis isopropil alkohol (CH3)2CHOH dan Butlerov sendiri berhasil mensitesis t-butil alkohol (CH3)3COH. Keberhasilan ini membuktikan adanya alkohol primer dan tersier dan kemudian mengukuhkan konsep struktur kimia.
Kimiawan Perancis Michel Eugène Chevreul (1786-1889), seorang kontempori, menemukan bahwa lemak adalah senyawa asam lemah (asam karboksilat alifatik) dan gliserin, dan zat mirip lemak dapat diperoleh dari reaksi antara asam lemak dan gliserin. Berthelot menulsi buku teks “Kimia Organik” tahun 1860 yang didalamnya ia menggunakan istilah “sintesis”. Ia mendeklarasikan secara prinsip seyawa organik apapun dapat disintesis dari karbon, hidrogen, oksigen dan nitrogen.
Jadi, filosofi dasar kimia sintesis dikukuhkan di pertengahan abad 19. Secara praktis sintesis bukan berarti mudah. Di tahun 1856, seorang anak muda Inggris William Henry Perkin (1838-1907), yang juga asisten August Wilhelm von Hofmann (1818-1892) , yang waktu itu di London karena diminta membuat sistem untuk pendidikan kimia, berusaha mensintesis kuinin. Kuinin diketahui sebagai obat khusus untuk malaria.
Di waktu itu, belum ada metoda sintesis senyawa serumit kuinin dari senyawa organik sederhana. Perkin memiliki ide bahwa kuinin mungkin dapat dihasilkan dari oksidasi aliltoluidin, yang rumus rasionalnya mirip dengan kuinin. Fakta sebenarnya hal ini tidak mungkin, dan memang usaha sintesisnya gagal. Alih-alih mendapatkan kuinin, Perkin mendapatkan pewarna yang cantik, yang disebut Mauve atau Mauvein, yang kemudian menjadi pewarna sintetis pertama yang digunakan untuk keperluan praktis. Sukes tak terencana ini menumbuhkan industri kimia dengan cepat. Namun, kesukaran sintesis organik tetap tak terpecahkan.

Gambar 11.1 Keberuntungan besar! Dengan oksidasi aliltoluidin Perkin mendapatkan,
Bukan kuinin yang ia cari, tetapi pewarna buatan, Mauve.
Baru 88 tahun kemudian di tahun 1944 kimiawan Amerika Robert Burns Woodward (1917-1979) dapat mensintesis kuinin dengan pendekatan sistematis.
sumber : http://www.chem-is-try.org/materi_kimia/kimia_dasar/sintesis_material/lahirnya-konsep-sintesis/
http://howgreenareyou.files.wordpress.com/2009/07/fosgen.jpg
http://majarimagazine.com/wp-content/uploads/2008/10/fig1_teknologi_gtl.png






 i
i